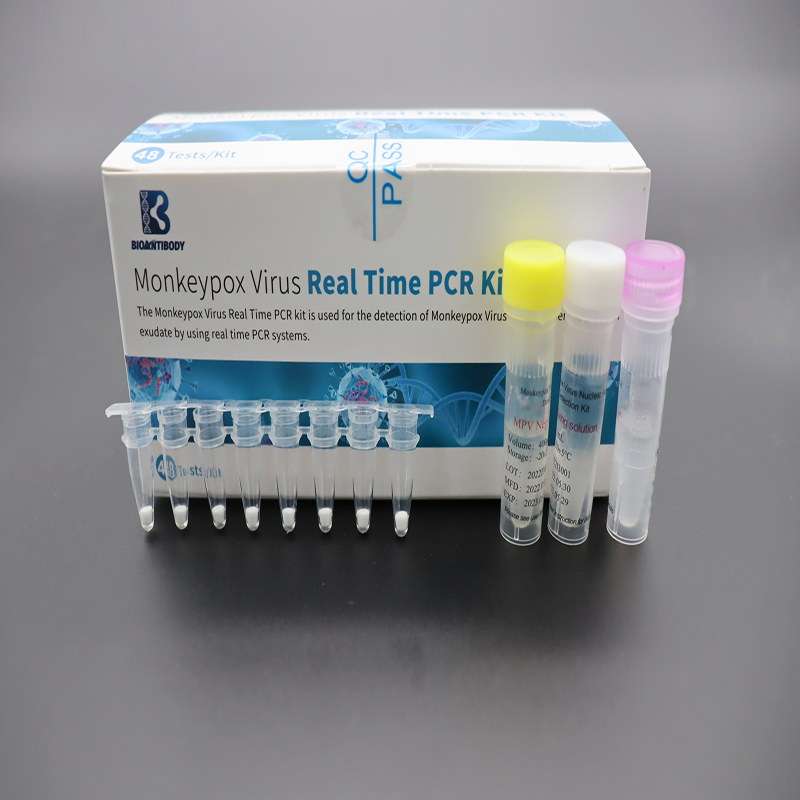
猿痘ウイルスリアルタイム PCR キット
製品詳細
使用目的
リアルタイム PCR システムを使用して、ヒト血清または病変浸出液サンプル中のサル痘ウイルスを検出するために使用されます。
試験原理
本製品は、蛍光プローブをベースとした Taqman® リアルタイム PCR アッセイシステムです。特異的なプライマーとプローブは、サル痘ウイルスの F3L 遺伝子の検出用に設計されています。ヒトの保存遺伝子をターゲットとした内部コントロールは、偽陰性の結果を回避するために、サンプル収集、サンプル処理、およびリアルタイム PCR プロセスを監視します。このキットは、完全にプレミックスされた凍結乾燥システムであり、サル痘ウイルス検出に必要な材料(核酸増幅酵素、UDG 酵素、反応緩衝液、特異的プライマーおよびプローブ)が含まれています。
主な内容
提供されるコンポーネントを表に示します。
| コンポーネント | パッケージ | 材料 |
| サル痘ウイルス凍結乾燥プレミックス | ストリップ PCR チューブ 8 本×6袋 | プライマー、プローブ、dNTP/dUTP Mix、Mg2+、Taq DNA ポリメラーゼ、UDG 酵素 |
| MPV ポジティブコントロール | 400μL×1チューブ | 標的遺伝子を含むDNA配列 |
| MPV ネガティブコントロール | 400μL×1チューブ | ヒト遺伝子セグメントを含む DNA 配列 |
| 溶解液 | 1mL×1チューブ | スタビライザー |
| 適合証明書 | 1個 | / |
操作の流れ
1.サンプルコレクション:検体は以下に従って滅菌チューブに採取する必要があります。
標準的な技術仕様を備えています。
2. 試薬の準備(試薬準備エリア)
キットのコンポーネントを取り出し、スタンバイ使用のために室温でバランスをとります。
3. 検体処理(検体処理エリア)
3.1 核酸抽出
ウイルス DNA 抽出キットの対応する要件と手順に従って、核酸抽出用に 200μL の液体サンプル、ポジティブコントロールおよびネガティブコントロールを採取することをお勧めします。
3.2 凍結乾燥粉末の溶解とテンプレートの添加
サンプル数に応じて、サル痘ウイルス凍結乾燥プレミックスを調製します。1 つのサンプルには、凍結乾燥プレミックス粉末を含む 1 本の PCR チューブが必要です。ネガティブコントロールとポジティブコントロールは 2 つのサンプルとして扱う必要があります。
(1) 凍結乾燥プレミックスを含む各 PCR チューブに溶解液 15 μL を加え、抽出サンプル/ネガティブ コントロール/ポジティブ コントロール 5 μL を各 PCR チューブにそれぞれ加えます。
(2) PCR チューブをしっかりと覆い、凍結乾燥粉末が完全に溶解して混ざるまで手で PCR チューブをはじき、瞬間低速遠心分離により液体を PCR チューブの底に集めます。
(3) 検出に一般的なリアルタイム PCR 装置を使用する場合は、PCR チューブを増幅エリアに直接移します。検出に BTK-8 を使用する場合は、次の操作を実行する必要があります。PCR チューブから BTK-8 の反応チップウェルに 10 μL の液体を移します。1 本の PCR チューブはチップ上の 1 つのウェルに対応します。ピペット操作中は、ピペットが 90 度垂直になっていることを確認してください。エアロゾル バリア ピペット チップは、適度な力でウェルの中心に配置し、最初のギアに達した時点でピペットを押すのを止めます (泡を避けるため)。ウェルが満たされた後、すべてのウェルを覆うように反応チップのメンブレンを取り出し、チップを増幅検出エリアに移します。
4. PCR増幅(検出領域)
4.1 PCR チューブ/反応チップを反応タンクに入れ、各反応ウェルの名前を対応する順序で設定します。
4.2 検出蛍光の設定:(1)サル痘ウイルス(FAM)。(2) 内部統制 (CY5)。
4.3 次のサイクリング プロトコルを実行します。
ABI7500、Bio-Rad CFX96、SLAN-96S、QuantStudio のプロトコル:
| ステップ | 温度 | 時間 | サイクル | |
| 1 | 変性前 | 95℃ | 2分 | 1 |
| 2 | 変性 | 95℃ | 10秒 | 45 |
| アニーリング、伸長、蛍光取得 | 60℃ | 30秒 | ||
BTK-8のプロトコル:
| ステップ | 温度 | 時間 | サイクル | |
| 1 | 変性前 | 95℃ | 2分 | 1 |
| 2 | 変性 | 95℃ | 5秒 | 45 |
| アニーリング、伸長、蛍光取得 | 60℃ | 14秒 | ||
5. 結果分析(装置のユーザーマニュアルを参照してください)
反応後、結果は自動的に保存されます。「分析」をクリックして分析すると、機器は結果列の各サンプルの Ct 値を自動的に解釈します。ネガティブコントロール及びポジティブコントロールの結果は、下記「6.品質管理」に準拠するものとする。
6. 品質管理
6.1 ネガティブコントロール: FAM チャネルでは Ct なし、または Ct>40、正常な増幅曲線を持つ CY5 チャネルでは Ct≤40。
6.2 陽性コントロール: 正常な増幅曲線を持つ FAM チャネルでは Ct ≤ 35、正常な増幅曲線を持つ CY5 チャネルでは Ct ≤ 40。
6.3 上記の基準がすべて満たされている場合、結果は有効です。それ以外の場合、結果は無効になります。
結果の解釈
次のような結果が考えられます。
| FAMチャンネルのCt値 | CY5チャンネルのCt値 | 解釈 | |
| 1# | Ct なし、または Ct>40 | ≤40 | 猿痘ウイルス陰性 |
| 2# | ≤40 | あらゆる結果 | 猿痘ウイルス陽性 |
| 3# | 40~45 | ≤40 | 再テスト。まだ 40 ~ 45 の場合は 1# として報告します |
| 4# | Ct なし、または Ct>40 | Ct なし、または Ct>40 | 無効 |
注記: 無効な結果が発生した場合は、サンプルを収集して再度テストする必要があります。
注文情報
| 商品名 | 猫。いいえ | サイズ | 検体 | 貯蔵寿命 | トランス。&Sto.温度 |
| 猿痘ウイルスリアルタイム PCR キット | B001P-01 | 48 テスト/キット | 血清/病変滲出液 | 12ヶ月 | -25~-15℃ |